简智恒 李佳岩 丁轩 吴开华 李士雪 陈海东 陈刚
珠海市人民医院(暨南大学附属珠海医院)神经外科 519000
通信作者:陈刚,Email:jhy_501@163.com
医学领域目前已经进入精准医疗时代。快速发展的计算机技术促进了医学影像技术和计算机辅助手术技术的进步,为精准化手术提供了基础。其中,医疗三维模型,影像三维重建技术在脑肿瘤的精准化手术中起着重要作用,它可以提供结构空间关系的视觉信息图,为术者提供立体的可视化的信息,从而为手术入路设计、脑肿瘤切除及脑功能保护等提供帮助。目前针对该技术在脑肿瘤手术中的应用价值分析已有大量的研究报道[1-4]。但大部分的研究只是基于单模态影像的三维重建技术,即单纯的 MRI 或 CT 影像三维重建,并不能显示与脑肿瘤手术相关的所有脑组织结构的信息。多模态影像融合三维重建技术可以将 CT 及 MRI 等不同类型的影像数据进行配准融合及三维重建,从而使得颅骨、脑肿瘤、正常脑组织、脑血管、神经等在同一图像中立体显示,对比单模态影像的三维重建技术,该技术能显示颅内各结构间的空间毗邻关系,对脑肿瘤手术方案的制定及入路选择具有更大意义。近年来,珠海市人民医院神经外科在收治的部分脑肿瘤患者中开展了术前多模态影像融合三维重建技术的应用,笔者现将具体的应用情况、效果及心得体会报道如下,以期为临床同道提供一些经验借鉴。

一、资料与方法
1. 一般资料:选择珠海市人民医院神经外科自 2019 年10月至2020年9月收治的46例接受开颅手术的脑肿瘤患者为研究对象,其中男性 17例,女性 29例;年龄(42.2±14.5)岁,范围为 13~77岁;肿瘤位于幕上者有 30例,包括大脑凸面 20例、颅底6例、鞍区4例;肿瘤位于幕下者有16例,包括脑干1例、小脑4例、岩斜区/桥小脑角/枕颈交界区11例。本研究经珠海市人民医院医学伦理委员会审核批准 (批号 :ZY.No20201001b06011231)。
2. 影像数据采集:(1)应用美国GE公司产Revolution CT(128 排)扫描仪进行 CT 检查,扫描层厚为 2 mm。(2)应用荷兰 Philips 公司产 3.0T Achieva TX MR 扫描仪进行 MRI 检查,扫描序列包括平扫和增强扫描的 3D T1像(回波时间 3.9ms、重复时间 8.4 ms、矩阵 256×256、视野 256 mm×256 mm、层厚 l mm)、3D T2 像(回波时间 265 ms、重复时间 2500 ms、矩阵 256×256、视野 256 mm×256 mm、层厚 1 mm)、3D T2 液体衰减反转恢复(FLAIR)序列(回波时间 325 ms、重复时间4800 ms、矩阵 256×256、视野 256 mm×256 mm、层厚 1 mm)、对比增强磁共振静脉成像(CE-MRV)(回波时间1.62 ms、重复时间 4.7 ms、矩阵 256×256、视野 256 mm×256 mm、层厚 1mm)、对比增强磁共振血管成像(CE-MRA)(回波时间 1.62ms、重复时间 4.7 ms、矩阵 256×256、视野 256 mm×256 mm、层厚1 mm)。
3. 影像数据导入及配准融合、三维重建:将术前 CT 及MRI的 DICOM格式数据导入至美国 GE公司的 AW4.4工作站软件,然后对影像数据进行如下处理:(1)使用 ImageFusion 模块将不同序列的 MRI及 CT 影像进行配准融合,以特征性解剖标记(如眼球中心、垂体窝、窦汇、乳突尖、二腹肌沟顶点等)为配准参考点。每例患者采用3~5个参考点。(2)使用 Object Creation 模块自动分割出脑组织、脑血管和神经,软件自动完成三维重建,使用Smart Brush功能手工勾画出脑瘤的位置,使用 3D-Restruction 模块自动三维重建颅骨。(3)模拟手术体位,展示及观察融合重建好的颅骨、脑组织、脑血管、脑肿瘤、神经等,并调整各自的透明度。最后术者根据融合重建后的三维数字化影像,设计手术入路并制定手术计划。
4.应用价值评价:参考Oishi等[5]对影像融合技术在微血管减压术前手术计划制定中的应用价值分级标准,本研究也以术者的一致性等级来评价术前多模态影像融合三维重建技术对脑肿瘤手术的应用价值:术后由主刀医生与助手分别对每一例患者的效果作出评价。如果主刀医生与助手的评价结果不一致,以主刀医生的意见为主。效果分为 3级:(1)价值突出:融合重建后的三维数字化影像对完成该手术有重要的指导意义,单纯应用二维图像阅片无法达到预期的手术效果;(2)有价值:通过二维图像阅片也能达到预期的手术效果,但融合重建后的三维数字化影像能提供细微结构上的更清晰、更直观显示,可以减少手术副损伤,为手术提供帮助;(3)无价值:通过单纯二维图像阅片即能按预期设想完成手术,无需多模态影像融合三维重建技术的辅助。
5. 手术效果及并发症评估:患者术后均参照术前影像学检查标准,完成头颅 CT 及颅脑 MRI 的复查,并依据术后复查的影像资料再次完成多模态影像融合三维重建。对比术前术后三维数字化影像的差异,以分析肿瘤切除程度及手术入路相关并发症情况。

二、结果
1. 多模态影像融合三维重建效果:46 例患者均完成了术前及术后的多模态影像融合三维重建,融合后的多模态影像可进行任意旋转,表面结构变成透明或半透明,从而有效地显示出内部感兴趣结构;三维数字化影像能清楚地显示脑肿瘤的大小、位置、形状以及其与周围结构的解剖关系,例如脑表面及深部的静脉和动脉影像三维重建均能清晰地显示脑肿瘤与脑血管之间的关系,可以在同一图像中清楚观察到复杂的脑肿瘤与正常脑组织的边界以及其与脑血管、颅骨的关系。46例患者的融合重建后三维数字化影像均与术前原始影像及术中所见基本相符,也清楚地显示出与手术入路相关的解剖结构的信息。典型的融合重建后三维数字化影像效果见图1~4。
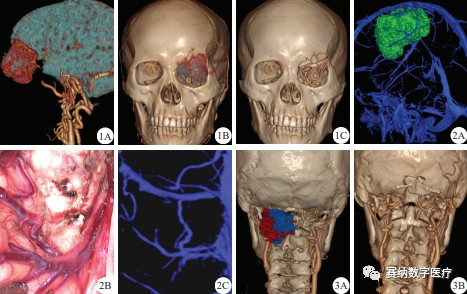
1A:脑组织/脑肿瘤/脑血管的影像融合三维重建效果,
1B、1C:术前及术后的颅骨/脑肿瘤/脑血管的影像融合三维重建效果;
2A:引流静脉影像与额顶叶巨大脑膜瘤的影像融合三维重建效果,
2B:额顶叶巨大脑膜瘤中Rolandic静脉术中所见,
2C:Rolandic静脉的影像融合三维重建效果;
3A:术前,3B:术后
图1 1例复杂颅眶沟通瘤的多模态影像融合三维重建效果展示
图2 多模态影像融合三维重建后引流静脉与脑肿瘤的空间关系展示
图3 1例枕颈交界区神经鞘瘤手术前后的颅骨/脑肿瘤/脑血管的多模态影像融合三维重建效果
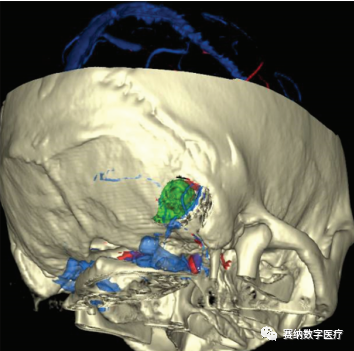
图4
1例听神经瘤术前多模态影像融合三维重建效果
2. 应用价值评价结果:46例患者中,主刀医生与助手对术前多模态影像融合三维重建技术的应用价值评价一致者有 45例,不一致者为 1例小脑血管母细胞瘤,主刀医生认为价值突出,助手认为有价值,最终评价结果以主刀医生的意见为主,故整体评价为价值突出者36例、有价值者8例、无价值者2例。
3. 手术效果及并发症情况:43 例患者于显微镜下完成肿瘤全切除,3例患者予肿瘤部分切除,其中1例为乳腺癌脑干转移,1例为外耳道鳞癌颅内浸润(颅内外沟通瘤),1例为视神经管脑膜瘤。所有患者术后均无入路相关并发症发生。术后病理结果回报示胶质瘤9例、脑膜瘤21例、转移瘤4例、听神经瘤 5 例、垂体瘤 2 例、三叉神经鞘瘤 1 例、血管母细胞瘤 1 例、海绵状血管瘤 1 例、枕颈交界区神经鞘瘤 1 例、胆脂瘤 1 例。34 例患者出院后进行了随访,随访时间 3~6 个月,MRI复查均示无肿瘤复发。

三、讨论
术前了解脑肿瘤及其与周围结构之间的解剖关系对于脑肿瘤手术的精准实施有着关键性意义。既往的CT或MRI单模态影像已无法满足神经外科精准手术的需求。一个能够清楚、直观、整体地显示脑肿瘤及其与周围脑血管、神经、脑组织的关系,以及与手术入路相关的颅骨结构的影像学技术,才能适应神经外科精准手术的发展。多模态影像融合是将相同或不同成像设备所获取的同一组织或器官的影像,依靠计算机技术进行配准、叠加等变换处理,产生出一种综合的影像信息[6]。在这一技术的帮助下,神经外科医生能够通过大量的影像数据的融合来实现可视化的解剖结构影像的三维重建,从而可以从各个视角明确脑肿瘤与周围组织结构的关系;并且基于该技术,在术前通过明确与手术入路相关的颅骨、脑组织、脑血管、神经等结构的信息,从而更精准地设计手术切口及骨瓣大小,更有效地避开脑功能区及重要血管等[7-8]。另外,可视化的解剖结构影像的三维重建还可以帮助神经外科医生增加对脑内复杂解剖结构及肿瘤病理性质的理解等,从而在手术切除肿瘤过程中提供更大的帮助[9]。
我们对46例脑肿瘤患者的术前影像资料进行了多模态影像融合三维重建,发现融合重建的三维数字化影像可清晰显示脑肿瘤的大小、位置、形状以及其与周围结构的解剖关系,有效指导手术入路的选择及脑肿瘤的精准切除,具体的心得体会包括:
(1)在复杂的颅底肿瘤手术中,该技术可以清楚地显示脑肿瘤与颅骨之间的关系。例如在本组1例眼眶-颅脑沟通性视神经管脑膜瘤患者中,该技术清楚地显示了脑肿瘤对前颅底、眶周及视神经管骨质的侵犯程度。
(2)在术前制定手术方案时,通过融合重建后的三维数字化影像,可以准确定位脑血管与脑肿瘤的关系。例如在判断脑肿瘤与引流静脉的空间关系方面,我们就通过该技术构建的影像发现,在20例大脑凸面肿瘤患者中,骨窗内见引流静脉紧靠脑肿瘤前方者有5例,紧靠脑肿瘤后方者有6例,横跨脑肿瘤表面者有3例,其余6例骨窗内仅见到肿瘤、未见与之关系密切的回流静脉,因此,我们在开颅过程中就可以注意对引流静脉进行有效的回避并加以保护。例如在本组 1 例额顶叶交界区凸面巨大脑膜瘤患者中,多模态影像融合三维重建技术清楚地显示了脑肿瘤位于Rolandic静脉的下前方,清晰地显示了整个静脉及其与上矢状窦、分支小静脉、脑肿瘤的关系,而传统的二维图像不能清晰地显示出这条静脉的整个脉络,从而有效地帮助术者减少了肿瘤切除过程中静脉损伤的可能性。此外,在判断脑肿瘤与脑动脉的空间关系方面,我们也曾通过该技术清楚地观察到动脉被脑肿瘤推移者有7例,被脑肿瘤包裹者有 3 例,明确这些信息后,就有利于术者在术中预判被脑肿瘤包裹的动脉的空间位置,从而可以更从容地分块切除肿瘤、更小心地保护好动脉。
(3)在枕颈交界区脑肿瘤手术及相关动脉保护方面,多模态影像融合三维重建技术对术前手术方案的制定也有很大帮助。例如在本组 1例枕颈交界区神经鞘瘤患者中,多模态影像融合三维重建技术清楚地显示了脑肿瘤与右侧椎动脉及颈椎棘突、椎间孔、枕大孔区周围骨性结构的关系,发现脑肿瘤破坏了颈2椎间孔,完整包绕了椎动脉的横突段、寰椎段、枕大孔段,因此当手术切除此肿瘤时,可以更从容地肿瘤、保留动脉。
(4)通常情况下,脑深部肿瘤的切除往往要考虑入路损伤问题,骨瓣的设计必须达到避免静脉损伤的同时也更容易地切除肿瘤。而在本组1例听神经瘤患者中,通过对融合重建后的三维数字化影像的仔细观察,在设计骨瓣时精确地定位了横窦及乙状窦在颅骨表面的投影位置,从而在铣刀铣开骨瓣时避免了横窦、乙状窦的损伤。
(5)另外,在很多低级别胶质瘤中,大脑表面肿瘤与正常脑组织的边界常不清楚,致肿瘤难以辨认、术中定位困难,常常需要术中电生理监测辅助以避免功能区副损伤。既往 Mert等[10]曾采用多模态影像融合三维重建技术辅助切除低级别胶质瘤,融合重建后的肿瘤影像准确地显示了肿瘤与其周边脑组织之间的关系,从而借助这项技术,有效地减少了术中神经电生理监测区范围及手术时间。但比较遗憾的是,目前我们针对 MRI 强化不明显的低级别胶质瘤患者的多模态影像融合三维重建的实践仍开展得比较少,具体效果及其经验体会有待进一步的总结。
本组 2 例一致性等级评价为无价值的患者均为额叶大脑凸面脑膜瘤,肿瘤直径均小于3 cm,术前MRI T2显示肿瘤边界清晰,强化中等均匀,肿瘤内部及周边未见重要血管,位于相对功能哑区,手术难度并不大,因此评价术前多模态影像融合三维重建技术对手术并无太大帮助。还有 1 例主刀医生与助手对多模态影像融合三维重建技术的价值评价不一致患者为右侧小脑血管母细胞瘤,由于供血动脉在术前二维图像中已较清楚地显示,因此助手给予有价值的评价,但主刀医生认为二维图像未能清楚地显示瘤结节与供血动脉之间的关系,而融合重建后的三维数字化影像上脑肿瘤与供血动脉的空间关系显示得十分清楚,因此在造瘘探查肿瘤时有重要作用,故评价为价值突出。
总之,术前多模态影像融合三维重建技术能提供大量的可视化信息,在指导脑肿瘤手术的切口设计、手术入路选择以及脑肿瘤的精准切除、脑功能保护方面具有着广阔的应用前景。但目前也存在一些不足,例如在脑血管的影像重建方面,虽然我们应用了多种数据源如 3D 相位对比血管成像MRV、CE-MRA 或时间飞跃 MRA 重建,但没有一种方法可以将微小血管重建满意;例如在脑肿瘤的影像重建方面,通常使用 3D T1WI序列,当肿瘤强化明显时重建效果较好,而当肿瘤轻度强化或无强化时影像的重建比较困难。但我们相信,随着相关技术的进步,这些方面的不足都将会得到进一步的改善。
利益冲突
所有作者均声明不存在利益冲突

参 考 文 献:
[1] Nandish S, Prabhu G, Rajagopal KV. Multiresolution image registration for
multimodal brain images and fusion for better neurosurgical planning[J]. Biomed J, 2017, 40(6): 329-338. DOI:10.1016/j.bj.2017.09.002.
[2] Hoffmann N, Weidner F, Urban P, et al. Framework for 2D-3D image fusion of
infrared thermography with preoperative MRI[J].Biomed Tech (Berl), 2017, 62(6): 599-607. DOI: 10.1515/bmt-2016-0075.
[3] Neuberger I, Hankinson TC, Meier M, et al. Utility of imagefusion software in
identifying shunt malfunction[J]. Childs NervSyst, 2020, 36(4): 749-754. DOI: 10.1007/s00381-019-04385-9.
[4] Inoue HK, Nakajima A, Sato H, et al. Image fusion forradiosurgery, neurosurgery and hypofractionated radiotherapy[J].Cureus, 2015, 7(3): e252. DOI: 10.7759/cureus.252.
[5] Oishi M, Fukuda M, Hiraishi T, et al. Interactive virtual simulationusing a 3D
computer graphics model for microvasculardecompression surgery[J]. J Neurosurg, 2012, 117(3): 555-565.DOI: 10.3171/2012.5.JNS112334.
[6] Hirano T, Ichikawa K, Wanibuchi M, et al. Accuracy of computedtomography-magnetic resonance imaging image fusion using a phantom for skull base surgery[J]. J Neurosurg Sci, 2019. DOI:10.23736/S0390-5616.19.04621-6.
[7] Li J, Zhang Y, Le H, et al. Application of multimodal image fusiontechnology in brain tumor surgical procedure[J]. Translational Neuroscience and Clinics, 2016, 2(4): 215-226. DOI: 10.18679/CN11-6030_R.2016.035.
[8] 尹腾昆, 王守森 . 矢状窦旁脑膜瘤相关的静脉循环评估及其手术价值研究进展[J]. 中华神经医学杂志, 2018, 17(7): 738-741.DOI: 10.3760/cma.j.issn.1671-8925.2018.07.019.
Yin TK, Wang SS. Venous assessment and surgical strategy inparasagittal meningiomas[J].Chin J Neuromed, 2018, 17(7): 738-741. DOI: 10.3760/cma.j.issn.1671-8925.2018.07.019.
[9] Sato M, Tateishi K, Murata H, et al. Three-dimensionalmultimodality fusion imaging as an educational and planning toolfor deep-seated meningiomas[J]. Br J Neurosurg, 2018, 32(5):509-515. DOI: 10.1080/02688697.2018.1485877.
[10] Mert A, Buehler K, Sutherland GR, et al. Brain tumor surgerywith 3-dimensional surface navigation[J]. Neurosurgery, 2012, 71(2 Suppl Operative): ons286-294; discussion ons294-295. DOI:10.1227/NEU.0b013e31826a8a75.
文章摘自中华神经医学杂志2021年11月 第20卷 第11期
原编辑:刘凯
文章部分图片源自网络























